Poxvirus porcino: a propósito de dos casos clínicos en España - IVIS
←
→
Transcripción del contenido de la página
Si su navegador no muestra la página correctamente, lea el contenido de la página a continuación
Published in IVIS with the permission of the editor
ARTÍCULOS
Poxvirus porcino: a propósito
de dos casos clínicos en España
D Martín Jurado1, M Sheik Al Ard2, JM Saura3, E Magallón Botaya2 y MT Verde Arribas4.
1
Exopol; 2Inga Food SA; 3Nanta; 4Facultad de Veterinaria. Universidad Zaragoza.
Imágenes cedidas por los autores.
Resumen Abstract
En este artículo se describen dos casos de Poxvirus porcino congénito y se Poxvirus in Spain. About two clinical cases
confirma su diagnóstico definitivo por primera vez en España.
Ambos casos fueron similares en su presentación y evolución. La sintoma- This paper describes two cases of congenital porcine Poxvirus and its defin-
tología clínica apareció de manera esporádica en algunos lechones de un itive diagnosis confirmed for the first time in Spain.
pequeño número de camadas de dos granjas y en tres semanas desapareció Both cases were similar in their presentation and evolution. The clinical
el proceso. signs appeared sporadically in some piglets from a small number of litters
Se ha hecho un seguimiento de dos y un año respectivamente en cada una from two farms, and the process disappeared within three weeks.
de las granjas, no habiéndose presentado ningún otro caso hasta la fecha. There has been a follow-up of two and one year respectively in each of the
farms, and no other cases have been presented to date.
Palabras clave: Poxvirus, porcino, diagnostico, dermatología.
Key words: Poxvirus, swine, diagnosis, dermatology.
Contacto con el autor: e.magallon@nutreco.com
E
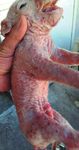
n los meses de marzo y abril de Los lechones con lesiones aparecían en di- crito anteriormente, en una granja de
2017 se presentó un problema ferentes camadas y siempre en cerdas mul- 350 cerdas situada en Pulpí, en el sur de
clínico en una granja de repro- típaras. En la misma camada nacían lecho- la provincia de Almería (Granja B). Esta
ductoras (Granja A), en la que nes tanto afectados como animales sanos. granja trabaja en bandas de tres semanas,
aparecieron lechones al nacimiento con Los lechones afectados nacían con un es PRRS positiva con un pase clínico al fi-
lesiones cutáneas pápulo-pustulares a peso normal, pero muy débiles. De hecho, nal de invierno y principios de primavera
vesiculares, costrosas y algunas ulcera- tres lechones de un total de seis que nacie- de 2019, pero en el momento de la apa-
das (figuras 1 y 2). La granja tiene una ron afectados, se llegaron a destetar. rición de los síntomas, verano del 2019,
capacidad de 2.500 cerdas, con genética Todos estos lechones recibieron trata- estaba totalmente estabilizada, con una
hiperprolífica, y está situada en Tauste miento vía intramuscular con amoxicilina media de destetados por banda superior a
(Zaragoza). La granja era PRRS positiva y corticoesteroide (dexametasona). 12,5 y la transición muy estable con me-
y estable, y Mycoplasma hyopneumoniae Con el paso de los días, las lesiones evo- nos de 1,5 % de bajas en animales de 7 a
positiva. En algunos lechones las lesiones lucionaron, llegando a desaparecer, sin 20 kg. Era Mycoplasma hyopneumoniae
se apreciaban desde el momento del naci- apenas dejar marcas en la piel, antes de positiva.
miento (figuras 1 y 2); en otros eran más destetarlos a los 28 días de vida. Poste- En una de las bandas, en la que había
evidentes cuando ya se habían secado los riormente, no han aparecido más casos. cuatro cerdas primíparas, dos de ellas
restos de las placentas que les cubren al Por otra parte, de junio a agosto de parieron dos y tres lechones con lesiones
nacer (figura 3). 2019 apareció otro caso similar al des- cutáneas pápulo-pustulosas, vesiculares
16 ■ SUIS Nº 174 Ene/Feb 2021Published in IVIS with the permission of the editor
ARTÍCULOS
Figura1. Granja A. Lechón de un día de vida con lesiones Figura 2. Granja A. Lechón de un día de vida con lesiones Figura 3. Granja A. Mismo lechón de figura 1 a los 5 días
pápulo-pústulares y costrosas desde el momento del pústulo-costrosas al nacimiento. de vida con lesiones pustulosas-costrosas en proceso de
nacimiento. cicatrización.
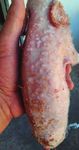
y costrosas (figuras 4 y 5), que eran muy
evidentes desde el momento del nacimien-
to. En el resto de las camadas del lote, los
lechones eran totalmente normales. Las
lesiones fueron desapareciendo con el
paso de los días y los lechones afectados,
aunque pesaban más de 1,5 kg en el mo-
mento del nacimiento, presentaban claros
signos de debilidad, fueron causando baja
y ninguno de ellos sobrevivió más allá
de quince días. El resto de camadas y los
lechones hermanos de los afectados se
destetaron sin ningún tipo de problema,
alcanzando el peso objetivo a su debido
tiempo.
Tres semanas más tarde, en la siguiente
banda se vuelven a presentar dos primeri-
zas con dos y tres lechones afectados con
las mismas lesiones en la piel. Por temor
a enfermedad contagiosa y dada la evolu-
ción de los lechones nacidos en la banda
anterior, se procedió a eutanasiar y enviar
muestras al laboratorio. El resto de los le-
chones permanecieron con buen estado y
sin signos de enfermedad.
En las biopsias cutáneas se observaron
lesiones de degeneración vacuolar en los Figura 4. Granja B. Aspecto de las lesiones pápulo-pustu- Figura 5. Granja B. Aspecto de las lesiones en áreas
diversos estratos de la epidermis, cuerpos lares en la zona dorsal. laterales y ventrales.
SUIS Nº 174 Ene/Feb 2021 ■ 17Published in IVIS with the permission of the editor
ARTÍCULOS
de inclusión eosinófilos intracitoplasmá- tología. Las granjas se mueven en unos aftosa, la enfermedad vesicular porcina,
ticos e infiltrado inflamatorio de predo- índices productivos muy elevados, tanto infecciones por parvovirus y el Virus del
minio linfoplasmocitico compatibles con en la tasa de partos, como en los nacidos Séneca. Pero también hay que considerar
infección por Poxvirus (figuras 6, 7, 8 y totales y destetados. otras enfermedades que producen erup-
9). En la sangre de las madres de los le- Las cerdas, en ambos casos, no presen- ciones cutáneas como erisipela, pitiriasis
chones afectados no se pudo hallar nada taron sintomatología clínica alguna y el rosea, dermatitis alergias, púrpuras trom-
reseñable. siguiente parto fue normal sin ninguna bocitopénicas, reacciones a picaduras de
En el seguimiento de ambas granjas, des- sintomatología de Poxvirus. insectos, dermatitis por Staphylococcus y
de la detección de los casos afectados por Streptococcus e incluso quemaduras
hasta el momento de la redacción de esta DIAGNÓSTICO DIFERENCIAL provocadas por el sol.
comunicación, no ha aparecido ningún El cuadro clínico presentado por todos Pero el listado del diagnóstico diferencial
otro caso clínico, se han dado partos de los lechones es de tipo pápulo-pustular, se reduce mucho cuando al tipo de lesio-
primerizas compañeras de lote de las cer- vesicular y costroso. Entre las causas nes se añade la característica de la edad de
das que gestaron los lechones con proble- que pueden ser responsables de este pa- aparición de las lesiones. Solo los proce-
mas y en ninguna camada han vuelto a trón en la especie porcina de hallan las sos inducidos por parvovirus y poxvirus
aparecer lechones con la misma sintoma- enfermedades vesiculares como la fiebre inducen infecciones congénitas; y de es-
Figura 6. Imagen histológica de biopsia cutánea del lechón B1. Hiperplasia y necrosis epidér- Figura 7. Detalle de la fig.6. donde se aprecian cuerpos de inclusión intracitoplasmáticos
mica. Degeneración vacuolar en los estratos superiores de la epidermis. Infiltrado dérmico de en el estrado epidérmico más superficial e intenso infiltrado dérmico con abundantes
predominio linfoplasmocitario. H&E. 100x. linfocitos, células plasmáticas y polinucleares en menor proporción. Destrucción necrótica
de la epidermis. H&E. 200x.
Figura 8. Imagen histológica de biopsia cutánea del lechón B2. Hiperqueratosis ortoquera- Figura 9. Imagen histológica de biopsia cutánea del lechón B2. Degeneración vacuolar
tósica. Degeneración vascular afectando al estrato basal y espinoso. Infiltrado inflamatorio o globosa localizada fundamentalmente en estrato espinoso. Necrosis epidérmica y
dérmico de grado medio con predominio de linfocitos y células plasmáticas. H&E. 200x. costra. Fuerte infiltrado inflamatorio dérmico formado por linfocitos, células plasmáticas y
neutrófilos. H&E. 200x.
18 ■ SUIS Nº 174 Ene/Feb 2021Published in IVIS with the permission of the editor
ARTÍCULOS
tas dos enfermedades, solo en el caso del
poxvirus, los signos clínicos aparecen en
lechones al nacimiento (figuras 10 y 11).
En la parvovirosis, las lesiones van apare-
ciendo a partir de la primera semana de
vida y hasta el mes de edad.
Teniendo en cuenta la presencia de otros
síntomas sistémicos, además del tipo de
lesiones y su distribución, podemos esta-
blecer el diagnóstico diferencial con:
1. La enfermedad vesicular que presenta
mortalidad baja, vesículas alrededor de
boca, lengua, y patas y madres afectadas;
2. La fiebre aftosa que es un proceso muy
contagioso, las madres no están afecta-
das, cursa con fiebre muy alta, cojeras
y depresión;
3. Dermatitis bacteriana que da lugar a
cuadros más exudativos y en lechones
jóvenes próximos al destete;
4. Dermatitis fúngicas o dermatofitosis
que suelen afectar tanto a madres como
a lechones y las lesiones no suelen ser
pápulo-pustulares ni vesiculares.
Además, hay que tener en cuenta que Figura 10. Lesiones pustulosas y costrosas en un lechón Figura 11. Lesiones papulares generalizadas en un lechón
los lechones nacidos en la misma pari- de un día de edad (Poxvirus porcino). con escasas horas de vida (Poxvirus porcino).
dera no estaban afectados, ni se conta-
giaron de los que si presentaban sinto-
matología. Observaciones macroscópicas agentes: Staphylococcus chromogenes,
Ambos animales presentaban lesiones Escherichia coli, Staphylococcus chromo-
DIAGNÓSTICO LABORATORIAL pustulosas-costrosas de tamaño en torno genes y Staphylococcus haemolyticus.
De la Granja A, no se pudo realizar diag- a 1 cm de diámetro, diseminadas por todo
nóstico laboratorial. el cuerpo (tronco dorsal y ventral, extre- PCR
En el caso de la Granja B se cogieron midades y cabeza).El resto de órganos Se analizaron muestras de tejido e hisopos
2 lechones muertos (B1 y B2), nacidos internos presentaban aspecto normal, a tomados de las pústulas, así como los sue-
débiles y que presentaban lesiones pápu- excepción de los riñones que presentaban ros de las cerdas mediante técnicas mole-
lo-pustulares al nacimiento y se extrajo color aclarado y aspecto inflamado y en culares (PCR) obteniendo los resultados
suero de las 2 cerdas que parieron estos los que se apreciaba un punteado miliar mostrados en la tabla.
lechones. El material fue enviado al labo- blanquecino en la corteza.
ratorio Exopol (San Mateo de Gállego, Diagnóstico histopatológico de las
Zaragoza) para realizar los análisis co- Cultivo microbiológico biopsias cutáneas
rrespondientes. Se obtuvieron muestras para cultivo de En las muestras de piel se observó hiper-
Se realizó la necropsia de los 2 lechones. las pústulas y crecieron los siguientes plasia epidérmica, hiperqueratosis orto-
queratósica, degeneración vacuolar o de-
generación globosa de los queratinocitos
Tabla. Resultados obtenidos en suero mediante PCR. de los estratos epidérmicos basal y espi-
noso, y la presencia de cuerpos de inclu-
Muestras Poxvirus (Cq)*
sión de aspecto eosinófilo en el citoplas-
Tejido pápula lechón 1 Positivo (16,63) ma de los queratinocitos de los estratos
más superficiales(figuras 6, 7, 8 y 9), así
Hisopo pápula lechón 1 Positivo (22,36)
como necrosis epidérmica. En la dermis se
Tejido pápula lechón 2 Positivo (18,28) observa infiltrado inflamatorio de grado
medio a intenso variando en función de
Hisopo pápula lechón 2 Positivo (27,70)
la gravedad de la lesión pápulo-pustular
Suero 920 Negativo y compuesto por linfocitos y células plas-
máticas, además de neutrófilos en las
Suero 910 Negativo
áreas necróticas. Estas lesiones son com-
Swine poxvirus: detección mediante PCR en tiempo real. Una muestra se considera positiva si patibles con una infección por poxvirus
tiene un valor de Cq ≤ 38.
porcino.
SUIS Nº 174 Ene/Feb 2021 ■ 19Published in IVIS with the permission of the editor
ARTÍCULOS
DISCUSIÓN Y RESULTADOS En los adultos el proceso es asintomático Los procesos debidos a Poxvirus porcino
La sintomatología, los análisis labora- sin la presencia de lesiones, o puede ser no son patologías de declaración obliga-
toriales e histopatológicos, así como el de carácter leve y autolimitante en un par toria, pues se trata de un virus que no su-
primer diagnóstico por PCR del que tene- de semanas. Sin embargo, en caso de in- pone ningún riesgo de Salud Pública.
mos constancia en España, confirman un fecciones congénitas, como las que se han
caso de Poxvirus porcino congénito. detectado en estas dos granjas en España, CONCLUSIONES
Poxvirus pertenece a la familia Poxviridae en los lechones que nacen afectados pue- ■ Se describen dos casos de Poxvirus
que incluye 2 subfamilias Chordopoxvi- den observarse altas tasas de mortalidad, porcinos congénitos, y se confirma
rinae (afectan a animales vertebrados) y si bien, sus madres, no presentan ninguna (diagnóstico definitivo) por primera
Entomopoxvirinae (que afectan a insectos). sintomatología. vez en un caso en España.
Poxvirus porcino pertenece a la subfami- No se tiene un conocimiento claro de la ■ Ambos casos fueron similares en su
lia Chordopoxvirinae y es el único dentro patogenia del poxvirus porcino congé- presentación y evolución. La sinto-
del género Suipoxvirus. nito, ni por qué solo una parte de la ca- matología clínica apareció de manera
La primera vez que se comunicó un pro- mada aparece afectada y el resto de los esporádica afectando a los lechones
ceso de Poxvirus porcino fue en América lechones no presentan ni una sola lesión. de un pequeño número de camadas de
del Norte en 1929 (McNutt et al. 1929) Entre las teorías a considerar se especu- dos granjas y en, escasamente tres se-
pero posteriormente se han descrito casos la con la posibilidad de que se presente manas, desapareció el proceso.
en todo el mundo. en lechones nacidos de cerdas con una ■ Se ha hecho un seguimiento de dos y
La transmisión en lechones adultos se viremia de bajo nivel que infectaría solo un año respectivamente en cada una
produce por vectores, normalmente pio- algunas membranas fetales. Por otra par- de las granjas (Granja A y B), no ha-
jos (Haematopinus suis), que afectan a los te, también se considera que, el hecho ca- biéndose presentado ningún otro caso
cerdos y suele darse en granjas con pro- racterístico de la compartimentación de hasta la fecha de la redacción de este
blemas de higiene, pero no siempre es así. las membranas placentarias en la especie trabajo.
En animales infectados el desarrollo de porcina, podría explicar por qué se afec-
la sintomatología clínica es esporádico y tan algunos lechones de la camada y otros Agradecimientos
depende de la edad; así, es más común en no; y también podría explicar por qué los Al Dr. José Antonio García de Jalón por
animales jóvenes (< 4 meses) donde puede afectados pueden estar en diferentes esta- el escaneado de las imágenes histológi-
llegar a ser grave. dios de la infección. cas.
BIBLIOGRAFÍA
Borst GHA, Kimman TG, Gielkens ALJ et al. Four sporadic cases of congenital swine- Murphy FA, Fauquet CM, Bishop DHL et al. Virus Taxonomy. Sixth report of the inter-
pox. Vet Rec. 1990; 127:61-63. national committee on taxonomy of viruses. Springer-Verlag, New-York, 1995; 79-
Cardona S, De Martino A, Urra M et al. Descripción de un caso de Viruela Porcina 91. McNutt SH, Murray C, Purwin P. Swine pox. JAVMA. 1929; 74:752.
Congénita. Rev. Suis. 2015; 114:14-17. Neufeld JL. Spontaneous pustular dermatitis in a newborn piglet associated with a
Doster A. Skin diseases of swine. Swine Health and Production. 1995; 3(6): 256-261. poxvirus. Can Vet J. 1981; 22:156-158.
House JA, House CA. Swine pox. In: Leman AD, Straw BE, Mengeling WL, D’Allaire Olinda RG, Maia LA, Cargnelutti JF et al. Swinepox dermatitis in backyard pigs in Nor-
S, Taylor DJ. Disease of Swine. 7th ed. Ames, IA: Iowa State University Press. 1992; theastern Brazil. Pesq. Vet. Bras. 36(6):468-472, junho 2016 DOI: 10.1590/S0100-
358-361. 736X2016000600002.
McNutt SH, Murray C, Purwin P. Swine pox. JAVMA. 1929; 74:752. Paton DJ, Brown IH, Fitton J, Wrathall AE. Congenital pig pox: a case report. Vet Rec;
McNutt et al. 1929. Diseases of Swine, 456-459 2019 1990; 127:204.
Medaglia, M.L.G. et al. Journal of Virological Methods. Número 219.10-13. 2015 Riyesh T et al. Comparative Immunology, Microbiology and Infectious Diseases. Nú-
Milho C, Andrade M, Vilas Boas D et al. International Journal of Pharmaceutics. 2018. mero 46. 60-65.2016
https://doi.org/10.1016/j.ijpharm.2018.12.004. Scott DW. Porcine Viral and Protozoal skin diseases. In Color Atlas of Farm Animal
Mulder WAM, Poelwijk F van, Moormann RJM et al. Detection of early infection of swine Dermatology. Wiley Blackwell. 2nd Ed. 2018: 215.
vesicular disease virus in porcine cells and skin sections. A comparison of immunohis- Thibault S, Drolet R, Alain R et al. Congenital swine pox: A sporadic skin disorder in
tochemistry and in-situ hybridization. Journal of Virological Methods.1997; 68: 169-175. nursing piglets. Swine Health and Production. 1998;6(6):276–278.
20 ■ SUIS Nº 174 Ene/Feb 2021También puede leer